Les mitochondries, au cœur des maladies neurodégénératives
Des maladies comme Alzheimer ou Parkinson pourraient être liées à un dysfonctionnement des mitochondries, qui produisent l’énergie au cœur des neurones. Une découverte qui ouvre de nouvelles pistes thérapeutiques. Sigrid März
|
Les mitochondries sont les centrales électriques de nos cellules. Le cerveau, qui consomme un cinquième de l’énergie totale du corps, en est rempli. Tant qu’elles fonctionnent bien, nous vaquons à nos occupations, nous rendons au travail, réfléchissons avec efficacité et concentration. Mais si ces organelles ne produisent plus assez de carburant pour nos activités intellectuelles, notre cerveau devient vulnérable aux troubles du métabolisme qui augmentent avec l’âge… De fait, les dysfonctionnements des mitochondries pourraient être à l’origine de nombreuses maladies cérébrales parmi les plus dévastatrices, comme la maladie d’Alzheimer ou de Parkinson.
À ce jour, on ne connaît aucun remède à ces pathologies neurodégénératives. En partie parce que leurs causes profondes ne sont pas encore connues. Aussi, l’hypothèse selon laquelle elles pourraient provenir des fameuses centrales électriques de nos cellules suscite un intérêt grandissant.
D’où vient cette hypothèse ? Dès 1970, deux chercheuses américaines observent au microscope électronique le cerveau de patients Alzheimer décédés. Elles constatent alors que leurs mitochondries diffèrent de celles de personnes en bonne santé. Elles ne savent pas encore pourquoi, mais quatre décennies plus tard, au début des années 2010, les choses se précisent : on découvre un lien entre cette perturbation des mitochondries et les mécanismes de la neurodégénérescence.
Des mitochondries partout
Les mitochondries sont partout dans votre corps. Seuls les globules rouges en sont dépourvus. On les trouve en nombre particulièrement élevé dans nos neurones. Les spécialistes peinent à s’accorder sur leur nombre exact : de quelques centaines à quelques dizaines de milliers par cellule, selon la taille de la cellule [nous en possédons donc entre 1 et 100 millions de milliards dans notre corps, ndlr]. Certains neurones dont les axones s’étendent sur 1 mètre de long pourraient même en contenir jusqu’à 2 millions.
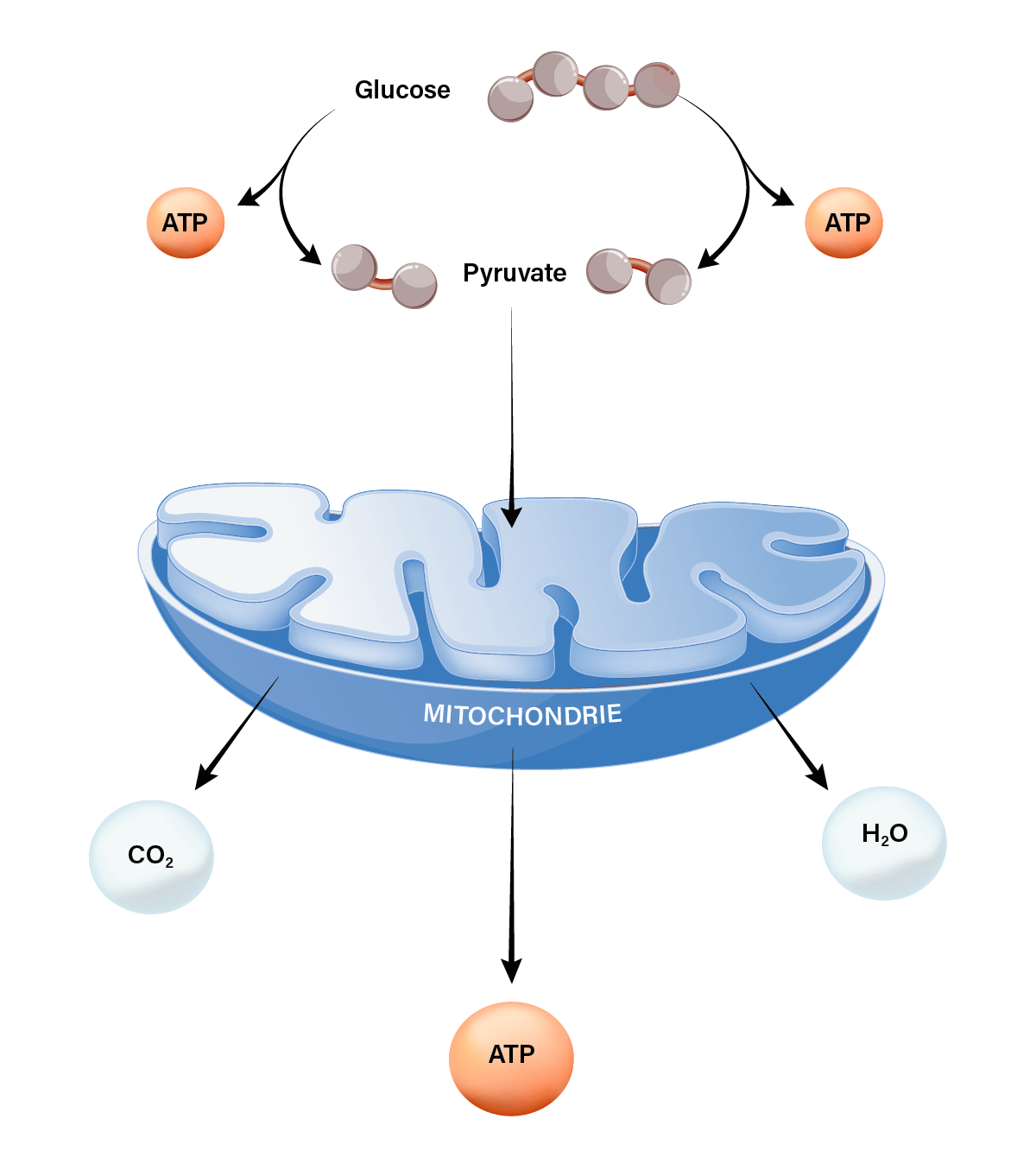
Les mitochondries possèdent, comme toutes les cellules vivantes, une membrane externe qui les sépare de l’extérieur, et qui laisse passer des ions ou de petites molécules. Mais elles ont en outre une seconde membrane interne sur laquelle se situent les composants de la chaîne respiratoire. Autrement dit, un ensemble de composés biochimiques qui exploitent l’énergie du glucose pour fabriquer une molécule appelée ATP, elle-même hautement énergétique, et qui va servir de carburant pour toutes les cellules de l’organisme. Enfin, les mitochondries renferment, à l’écart de l’ADN de l’individu à qui elles appartiennent et qui est stocké dans leur noyau cellulaire, leur propre patrimoine génétique constitué d’ADN mitochondrial (ADNmt).
Quand les problèmes commencent
Alors, quel est le problème avec les mitochondries ? Au cours de notre vie, à mesure que les années passent, des erreurs se glissent dans l’ADN mitochondrial. Ces erreurs se produisent aussi couramment sur l’ADN du noyau cellulaire qui contient nos gènes. Ce qui n’est pas un problème, car le corps est habitué à ces ratés et détient des mécanismes de réparation interne qui restaurent le code source de l’ADN. Mais dans les mitochondries, ces mécanismes sont beaucoup moins efficaces.
Autre point de vulnérabilité : alors que l’ADN contenu dans le noyau de nos cellules est protégé par des protéines appelées « histones », ce n’est pas le cas de l’ADN mitochondrial. Pire… La production d’ATP dans les mitochondries dégage des dérivés réactifs de l’oxygène (DRO), des molécules qui ont tendance à réagir facilement au contact des différents éléments des cellules vivantes. Dans les cellules en bonne santé, ces espèces chimiques sont dégradées à mesure qu’elles se forment, grâce à la présence d’agents antioxydants, dont un tiers est présent dans les mitochondries. Mais si les DRO augmentent de manière excessive – ce qui est le cas, notamment, à la suite d’une inflammation aiguë ou chronique –, les antioxydants ne suffisent plus à les maîtriser. Les DRO commencent alors à oxyder des molécules cruciales pour la cellule, tels les lipides, les neurotransmetteurs, l’ARN ou même l’ADN. Provoquant le risque de production défectueuse ou inexistante des protéines des chaînes respiratoires. Les mitochondries cessent alors de fonctionner correctement. Et finalement, la cellule meurt par manque d’énergie.
Parkinson, sclérose amyotrophique latérale
Quand cette pénurie énergétique touche les neurones dopaminergiques de la substance noire, dans le tronc cérébral, cela peut être le début d’une maladie de Parkinson. Avec des symptômes comme une difficulté à exécuter des mouvements fins, des tremblements, une raideur musculaire. De fait, plusieurs indices laissent entendre que des défauts mitochondriaux seraient en cause. Notamment, dans la forme héréditaire de la maladie de Parkinson, on relève des modifications (mutations) sur des gènes importants pour le fonctionnement des mitochondries.
Une autre conséquence dramatique est la sclérose latérale amyotrophique, en abrégé SLA, encore appelée maladie de Charcot. Cette maladie neurodégénérative chronique entraîne une faiblesse musculaire, une paralysie et se solde par une issue fatale. Au niveau cellulaire, on constate une dégénérescence des neurones moteurs qui commandent la contraction des muscles. Or, dans le génome mitochondrial de nombreux patients, les spécialistes ont effectivement trouvé une mutation du gène de l’enzyme SOD-1, chargée de neutraliser les dérivés réactifs de l’oxygène, les fameux DRO. Ce qui expliquerait la mort des neurones moteurs.
Responsables d’Alzheimer ?
Les mitochondries semblent également s’affaiblir dans le cerveau des malades d’Alzheimer. En 2021, une équipe de l’université Columbia, à New York, a découvert qu’elles contenaient moins de copies d’ADN mitochondrial que chez des personnes en bonne santé. Quant aux copies restantes, elles montraient plus de mutations – en clair, de défauts génétiques. Un lien a été découvert entre ce taux de mutations et la quantité de dépôts toxiques suspectés de provoquer la mort des neurones, des agrégats constitués d’une protéine appelée Tau. Ce lien était particulièrement clair dans le cortex préfrontal : plus les modifications dans les mitochondries étaient importantes, plus y on trouvait d’agrégats (ou neurofibrilles) de protéine Tau nocives.
Par ailleurs, on sait que l’apolipoprotéine E4 (ApoE4), le principal facteur de risque d’une forme de maladie d’Alzheimer qui se déclare à un âge tardif, réduit l’efficacité des mitochondries… Les personnes présentant cette variante génétique ont donc moins d’ATP – la molécule source d’énergie – dans le cerveau. Ce manque d’énergie affecte logiquement l’apprentissage et la mémoire. Un fait observé, pour l’instant, chez des souris de laboratoire.
Un lien avec l’accumulation de plaques amyloïdes
Jusqu’à présent, les thérapies courantes contre la maladie d’Alzheimer se focalisent sur les dépôts des protéines Tau et β-amyloïde, caractéristiques de la maladie. Toutes deux sont soupçonnées d’altérer le fonctionnement des mitochondries. Toutefois, le déclin de ces dernières commence avant même que l’accumulation des protéines nocives ne soit perceptible ; en fait, elle pourrait bien en être la cause. Les scanners cérébraux, qui mesurent l’absorption de glucose, montrent par exemple que les patients Alzheimer ont un métabolisme cérébral nettement ralenti dès les premiers stades de la maladie. Selon une équipe dirigée par Sandro Sorbi, de l’université de Florence, ce déficit énergétique conduit à une phosphorylation excessive des protéines Tau, ce qui les fait ensuite s’agglutiner en fibrilles [les enzymes chargées de limiter la phosphorylation de Tau, les phosphatases, sont très consommatrices d’énergie, ndlr]. Le même déficit énergétique enclenche aussi une production accrue de peptides β-amyloïdes, les composants des plaques d’Alzheimer. Autant d’éléments qui plaident pour une nouvelle stratégie thérapeutique : concevoir des médicaments qui agissent sur les mitochondries dès les premiers stades de la maladie.
Si la maladie d’Alzheimer est effectivement déclenchée par un métabolisme cellulaire perturbé, cela expliquerait pourquoi les approches thérapeutiques actuelles, qui s’emploient à éliminer les plaques à l’aide d’anticorps, n’améliorent généralement pas les capacités cognitives. Il existe déjà quelques médicaments alternatifs, initialement développés contre d’autres affections. Ainsi, en 2013, une étude de phase 2 a été menée sur la mitoglitazone (MSDC-0160), une substance active qui bloque le transporteur mitochondrial de pyruvate et qui était à l’origine prévue pour traiter le diabète, mais qui n’a jamais été autorisée. Chez seize patients atteints de démence légère d’Alzheimer, ce composé a stabilisé le métabolisme du glucose dans le cervelet. Un début…
Un autre candidat est l’érythropoïétine (EPO), une hormone naturelle à la triste réputation dans les milieux du dopage, mais qui favorise la formation et la maturation des globules rouges. Selon une étude de l’École polytechnique fédérale de Zurich, en Suisse, cette substance augmente également le nombre de mitochondries, accroissant ainsi la dégradation du glucose et augmentant le taux d’ATP dans les cellules. Elle a été testée sur des rats et des souris ayant des quantités insuffisantes de mitochondries dans une zone du cerveau essentielle à la mémoire, l’hippocampe. Après l’administration d’EPO, leur mémoire spatiale et leur mémoire à court terme se sont améliorées ! Mais l’EPO a également permis à des souris atteintes de la maladie de Parkinson de se rétablir, comme l’ont démontré Federica Rey et ses collègues de l’université de Milan, en 2021. La motricité des rongeurs s’est normalisée et les dommages subis par les mitochondries ont également diminué, comme l’ont montré des images obtenues au microscope électronique.
Autre essai encourageant : la térazosine, prescrite aux hommes souffrant d’hypertrophie de la prostate et de problèmes urinaires. On l’expérimente pour soigner Parkinson. Elle stimule en effet l’activité d’une enzyme qui participe à la dégradation du glucose et à la production d’ATP. Sa cousine doxazosine aurait le même effet. D’après une étude américano-danoise publiée en 2021, l’une et l’autre substances réduiraient le risque de développer la paralysie agitante.
La solution : greffer des mitochondries !
Restent les approches non chimiques. Parmi elles, la transplantation de mitochondries saines dans des cellules malades. Une approche développée par des chercheurs américains pour minimiser les séquelles cardiaques lors d’un épisode d’ischémie-reperfusion. L’ischémie-reperfusion est ce qui arrive à un organe privé d’irrigation sanguine pendant un moment, avant que la circulation soit rétablie. Cela arrive notamment lors d’un infarctus du myocarde : une partie du muscle cardiaque ne reçoit plus de sang, puis, lorsque le flux est rétabli, il peut malheureusement se produire des dégâts supplémentaires, car les mitochondries sont endommagées.
Les scientifiques du Beth Israel Deaconess Medical Center à Boston ont donc prélevé des mitochondries intactes dans les muscles périphériques de lapins présentant un manque d’irrigation cardiaque provoqué artificiellement et les ont injectées dans la région touchée. Les animaux se sont bien mieux rétablis que ceux qui n’avaient pas reçu de transplantation. De premiers essais ont eu lieu en 2017 sur de jeunes patients ayant subi une ischémie lors d’opérations. Avec des résultats concluants.
AVC et lésions cérébrales
En cas de lésion cérébrale consécutive à un AVC, quand une région du cerveau ne reçoit plus suffisamment d’oxygène, transplanter des mitochondries est aussi salutaire. L’opération a été testée avec succès sur des rats. Mais évidemment, il faut que les mitochondries transplantées soient en bon état. Ce n’est pas possible, par exemple, en cas de syndrome de Leigh – une maladie génétique qui affecte les mitochondries de toutes les cellules du corps .
En tout cas, on espère que cette méthode permette de soulager les maladies neurodégénératives. La dificulté : introduire les mitochondries directement dans le tissu cérébral. Car si on les injecte dans le sang, elles restent bloquées au niveau de la barrière hématoencéphalique, un fin réseau de vaisseaux sanguins qui joue le rôle de filtre et ne laisse passer que de toutes petites molécules du sang dans le cerveau. Certaines expériences sont encourageantes : on a réussi à administrer des mitochondries à des rats parkinsoniens sous forme de spray nasal… Les mitochondries atteignaient le cerveau en étant véhiculées par le nerf olfactif ! Elles ont sauvé 60 % des neurones de la substance noire, si importants pour le contrôle fin de la motricité. Et les rongeurs ont ensuite retrouvé une plus grande fluidité dans leurs mouvements. Malgré tout, la plupart des traitements se font aujourd’hui par des injections dans le cerveau.
Comment prendre de ses mitochondries au jour le jour
Alors, on cherche d’autres solutions. Magdalena Götz dirige l’Institut de recherche sur les cellules souches au centre Helmholtz de Munich, ainsi que le département de génomique physiologique au Centre biomédical de la LMU. Avec son équipe, elle tente de faire pousser de nouvelles cellules dotées de mitochondries saines exactement là où elles sont nécessaires dans le cerveau. Cette approche s’appelle la « reprogrammation neuronale » : certaines cellules gliales, les astrocytes, deviennent alors des neurones. Pour l’instant, il reste de nombreux problèmes à régler, car au moment où les astrocytes se transforment en neurones, ils ont tendance à mourir parce que leurs mitochondries restent des mitochondries d’astrocytes, qui émettent beaucoup de dérivés réactifs de l’oxygène, qui les tuent bien souvent. Comme le dit la chercheuse, « nous pouvons améliorer la reprogrammation en exprimant de manière ciblée des protéines mitochondriales typiquement neuronales ».
En attendant, nous pouvons prendre concrètement soin de nos mitochondries pour préserver à terme nos neurones des effets de l’âge. En 2024, une équipe de recherche dirigée par Caroline Trumpff, du centre médical Irving de l’université Columbia de New York, a démontré que le stress chronique – également de nature psychique – met à l’épreuve nos centrales électriques cellulaires. En contrepartie, des expériences psychosociales positives font l’effet d’un baume et augmentent considérablement l’abondance des protéines critiques de leur machinerie interne, si importante pour produire l’ATP vital à nos neurones. C’est aussi un mode de vie sain, une alimentation équilibrée et une pratique sportive régulière qui contribueront à ce que ces milliards de petites ouvrières de notre corps et de notre cerveau continuent à travailler efficacement pendant de longues années.
L'essentiel
Nous possédons des centaines de millions de milliards de mitochondries dans notre corps, qui produisent l’énergie nécessaire au fonctionnement de chacune de nos cellules.
Les neurones en dépendent directement, car il faut une forte consommation d’énergie pour voir, entendre, sentir, bouger, penser, parler…
Plusieurs dysfonctionnements génétiques, ou l’usure cellulaire liée à l’âge, peuvent conduire à une baisse de régime des mitochondries. En déficit énergétique, certains neurones meurent, comme dans la maladie de Parkinson ou la maladie de Charcot, ou peiner à réguler certaines protéines internes, provoquant la maladie d’Alzheimer.
Des traitements novateurs – notamment des greffes de mitochondries – pourraient corriger ses défauts, mais il est d’ores et déjà possible de prendre soin de ses mitochondries en évitant le stress chronique et en entretenant des relations sociales épanouissantes.
Sigrid März est docteure en biologie cellulaire et travaille comme journaliste scientifique à Münster, en Allemagne.